Химия вокруг нас
четверг, 13 марта 2014 г.
Значение растворов в природе и жизни человека. Раствор и его компоненты
Тема:
Значение растворов в природе и жизни человека. Понятие о дисперсных системах, коллоидных и истинных растворах. Раствор и его компоненты: растворитель, растворенное вещество
Задачи:
- сформировать понятие о растворах, признаках классификации растворов, отличиях истинных и коллоидных растворов;
- сформировать умения различать дисперсные системы;
- развивать умения сравнивать, анализировать;
- воспитывать культуру химических записей, химического языка.
- вода, калия перманганат, медный купорос, песок, бутылка с газированной минеральной водой, раствор соли, разбавленный чай;
- источник света (лазерная указка или фонарик), химические стаканы, стеклянные палочки, этикетки минеральной воды и сладких газированных напитков.
Тип урока: изучения новых знаний.
Вид урока: урок-лекция.
Приветствие, перекличка, проверка готовности к уроку
МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
Растворы и процесс растворения имеют огромное значение в природе, повседневной жизни, науке и технике.
Чаще всего мы имеем дело не с чистыми веществами, а с растворами или смесями. Вода морей, ре, озер, грунтовые воды, питьевая вода – это растворы. Большинство минералов – это твердые растворы. Соки растений, напитки, лаки, краски, лекарства – это растворы. Усвоение пищи связано с растворением питательных веществ. Растворы используются в промышленности: текстильной, металлообрабатывающей, фармацевтической, при производстве пластмасс, синтетических волокон, мыла. Большинство химических реакций происходит в растворах, живые организмы состоят из растворов – кровь, лимфа, межклеточная жидкость, цитоплазма.
АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ
Приведите примеры растворов, с которыми вы встречаетесь в повседневной жизни.
«Мозговой штурм»: Что вы знаете о растворах? Запись ответов на доске и в тетрадях
На какие вопросы вы бы хотели получить ответы на уроке? при изучении темы? – запись в тетрадях, зачитывают несколько учеников
- знать – раствор, классификация растворов, отличия истинных и коллоидных растворов;
- различать дисперсные системы;
- умения сравнивать, анализировать;
- вести химические записи.
ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
1. Понятие о растворах
Демонстрация: в сосуды с водой помещаем поваренную соль, сахар, медный купорос ( калия перманганат), песок. Количество вещества постепенно уменьшается. В случае с цветными веществами наблюдаем явление диффузии. При перемешивании процесс ускоряется
При этом вода приобретает новые свойства: у неё появляется вкус, цвет, изменяется плотность, Т кипения и др. Полученная жидкость уже не является водой. Это раствор.
Раствор – это однородная смесь веществ.
Профильтруем растворы – соль, сахар, медный купорос ( калия перманганат) – не удается отделить от воды. Эти вещества находятся в растворах в виде молекул. Эти растворы прозрачны и однородны. Это истинные растворы. Их основной признак – однородность.
При растворении песка в воде получаем смесь с крупинками песка, она непрозрачна и неоднородна. Крупинки постепенно оседают на дно, потому что песок нерастворим. При фильтрации они остаются на фильтре.
При растворении веществ происходит их измельчение и рассеивание в объёме раствора. Все растворы иначе называют дисперсными системами.
В растворе частицы одного вещества равномерно распределены между частицами другого.
В растворе всегда содержится растворитель (дисперсионная среда) и растворенное вещество (дисперсная фаза).

Групповая работа: рассмотреть этикетки минеральных вод и сладких напитков, определить их качественный и количественный состав.
Растворы, в отличие от химических соединений, не имеют постоянного химического состава.
Раствор = растворитель + растворенное вещество.
Растворитель – вещество, которое находится в том же агрегатном состоянии, что и раствор (или масса которого наибольшая).
Растворенное вещество может находиться в любом агрегатном состоянии: твердом, жидком, газообразном.
В растворах, в отличие от смесей, существует взаимодействие между частицами растворителя и растворенного вещества.
2. Смеси веществ с водой
В зависимости от степени измельчения веществ, смешиваемых с водой, выделяют несколько видов смесей:
- взвесь;
- коллоидный раствор;
- истинный раствор.
Основное отличие – величина частиц, распределенных в воде
Самостоятельная работа с текстом, заполнение таблицы
| Признаки сравнения | Взвесь | Коллоидный раствор | Истинный раствор |
|---|---|---|---|
| Величина частиц | 10–7 – 10–5 м Небольшие частицы | 10–9 – 10–7 м Скопления частиц | Равна величине молекул (ионов) |
| Оптические свойства | Непрозрачные, мутные | Прозрачные, рассеивают свет | Прозрачные, свет не рассеивают |
| Возможность разделения | Взвешенные частицы не проходят сквозь бумажный фильтр | Взвешенные частицы проходят сквозь бумажный фильтр, но не проходят сквозь пергаментный фильтр | Фильтрованием разделить невозможно |
| Устойчивость | Неустойчивы во времени, взвешенные частицы довольно быстро оседают на дно или всплывают на поверхность | Относительно устойчивы во времени, со временем стареют с образование осадка | Устойчивы во времени, не стареют, могут существовать бесконечно долго, если не происходит хим реакций |
Демонстрация эффекта Тиндаля
3. Классификация дисперсных систем по агрегатному состоянию измельченного вещества или растворителя
Запись таблицы в тетради с пояснением
| Растворитель | Измельченное вещество | ||
|---|---|---|---|
| Твердое | Жидкое | Газообразное | |
| Твердый | Твердые растворы (сплавы металлов, стекла) | — | Пены |
| Жидкий | Взвеси, суспензии, золи | Эмульсии (вода в масле, масло в воде) | Гидрозоли |
| Газообразный | Аэрозоли, дым | Аэрозоли, туманы | Смеси газов |
ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ЗНАНИЙ
Беседа по записанным учащимися в начале урока (актуализации) вопросам
- Почему речная, колодезная и талая вода имеют разный вкус?
- Какая из них наиболее чистая с химической точки зрения?
- От каких примесей в воде можно избавиться фильтрованием, отстаивание, дистилляцией?
ДОМАШНЕЕ ЗАДАНИЕ
- Проработать конспект, выучить определения.
- В 5 стаканов налили небольшие порции воды.
- В первый добавили глину,
- во второй – спирт,
- в третий – фруктовый сироп,
- в четвертый – керосин,
- в пятый – питьевую соду.
Каждую смесь хорошо перемешали. В каких стаканах образовались растворы?
- В строительстве применяют так называемый цементный раствор. Его компонентами являются цемент, песок и вода. Можно ли назвать эту смесь раствором с научной точки зрения?
- Какое вещество следует назвать растворителем, если раствор образуют:
- расплавленные металлы – медь массой 3г и золото массой 7г;
- вода объемом 1л и хлороводород (газ) объемом 300л;
- спирт массой 10г и ацетон массой 25г;
- вода массой 8г и сульфатная кислота массой 92г?
- Можно ли утверждать, что соки клубники, черной смородины являются растворами и содержат несколько растворенных веществ?
Значение растворов в природе и жизни человека
Растворы в жизни человека и сложнейшие биохимические реакции в клетках животных и растительных организмов. Особенности водного баланса, значимость соли и её растворимость в воде. Значение водно-солевых растворов для существования живых организмов.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 12.01.2012 |
| Размер файла | 12,9 K |

Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Донецкой областной школы I – III ступеней №85
Реферат на тему:
Значение растворов в природе и жизни человека
Учитель Гонтарь Геннадий Андреевич
биохимический клетка организм водно солевой баланс
Растворы в жизни человека имеют очень большое значение т.к. практически всё существование человека на них основано. Например вода, которая является очень разбавленным раствором. В ходе эволюции вода создала окружающую нас природу, живой мир, да и самого человека: именно водная среда (Мировой океан) могла обеспечить все требования к возникновению и развитию жизни. Именно она стала основателем , при специфических внешних условиях, жизни на Земле. Вода обеспечивает существование жизни на нашей планете: сложнейшие биохимические реакции в клетках животных и растительных организмов могут протекать только при наличии воды. С точки зрения химиков живое вещество – это водный раствор, и почти все процессы, обеспечивающие его жизнедеятельность, сводятся к химическим реакциям в водном растворе.
Человечество издавна уделяло большое внимание воде, поскольку было хорошо известно, что там, где нет воды, нет и жизни. Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды – Мировой океан. Круговорот воды – исключительно важный процесс. Он обеспечивает сушу пресной водой, которая постоянно возобновляется, в процессе этого круговорота, вода разрушает и растворяет твердые породы на суши и переносит их в другие места, с образованием наносов.
В здоровом организме взрослого человека наблюдается состояние водного равновесия, или водного баланса. Оно заключается в том, что количество воды, потребляемое человеком, равно количеству воды, выводимой из организма. Водный обмен является важной составной частью общего обмена веществ живых организмов, в том числе и человека. Общий объем воды, потребляемый человеком в сутки при питье и с пищей, составляет 2-2,5 л. Благодаря водному балансу столько же воды выводится из организма. Через почки и мочевыводящие пути удаляется около 50-60% воды. При потере организмом человека 6-8 % влаги сверх обычной нормы повышается температура тела, краснеет кожа, учащается сердцебиение и дыхание, появляется мышечная слабость и головокружение, начинается головная боль. Потеря 10% воды может привести к необратимым изменениям в организме, а потеря 15-20% приводит к смерти, поскольку кровь настолько густеет, что с ее перекачкой не справляется сердце.
Так же человеку требуется вода для приготовления пищи. В качестве питьевой может быть использована природная вода, если она не содержит вредных микроорганизмов, а также вредных минеральных и органических примесей, если она прозрачна, бесцветна и не имеет привкуса и запаха.
Природные воды, содержащие соли, растворенные газы, органические вещества в более высоких концентрациях, чем питьевая вода, называются минеральными. Поскольку вода является очень хорошим растворителем, в природе она всегда содержит растворимые вещества, так как не существует абсолютно нерастворимых веществ. Их количество и характер зависят от состава пород, с которыми вода находилась в контакте. Наименьшее количество примесей и растворенных веществ содержится в дождевой воде. Однако даже она содержит растворенные газы, соли, твердые частицы. Соли, содержащиеся в дождевой воде, попадают в нее из океанов и морей.
Одно из хорошо растворимых веществ в воде – это соль. Соль или раствор соли были известны человеку с древнейших времен. Тогда соль ценилась выше золота. Ведь как гласила пословица: «без золота прожить можно, а без соли — нельзя». Всем известно, что любая пословица содержит бесценную народную мудрость, а в данном случае можно с уверенностью сказать, что соль — это жизненно важное и незаменимое вещество для человека.
Доказательство значимости соли можно легко найти в истории — известны небывалые по масштабам соляные бунты, когда из-за нехватки этого вещества в стране народ отказывался подчиняться своему правительству.
Соль или раствор соли используют в лечебной практике (для компрессов, ванн, промывочных жидкостей), в быту (приготовление пищи, народная медицина), в химических лабораториях и пр. Несмотря на достаточно высокую эффективность соли, надо учитывать, что ее чрезмерное употребление может привести к нежелательным последствиям. Высокий уровень потребления соли может задерживать жидкость в организме, в кровеносной системе, привести к головной боли. Поэтому соль или раствор соли мы советуют использовать разумно и с особой осторожностью.
Без растворов не могут работать металлургические и химические заводы, предприятия лёгкой и пищевой промышленности, бытового обслуживания, медицинские учреждения.
В природе и в жизни человека растворы играют очень большую роль, потому что без них Жизнь не могла бы существовать. Без растворов воды люди бы могли наверно прожить только неделю, а без газового раствора т.е. кислорода всё человечество и животные погибли бы за считанные минуты.
Размещено на Allbest.ru
Подобные документы
Значение для человека микроэлементов. Основные макроэлементы, содержащиеся в клетках. Бромистый калий как сильное болеутоляющее средство для нервной системы. Кислород как основной химический элемент в организме человека. Роль цинка в жизни клетки.
презентация [5,6 M], добавлен 28.11.2012
Анализ места света в жизни организмов, в том числе и в процессе фотосинтеза. Оценка экологических пределов выносливости организмов. Энергия солнца как практически единственный источник энергии для всех живых организмов. Сущность и значение видимого света.
презентация [4,2 M], добавлен 26.11.2010
Понятие и принципы человеческого бытия как существования человека во всем многообразии его проявлений. Отличительные особенности человека от животных, их потребностей и способностей. Мотивы деятельности, их источники и значение в жизни человека.
презентация [157,0 K], добавлен 17.05.2014
Значение насекомых в природе и жизни человека. Особенности биологии паразитоформных клещей. Хищничество и паразитизм отряда Parasitiformes. Общая характеристика отряда Diptera. Меры профилактики и борьбы с кровососущими насекомыми человека и животных.
курсовая работа [1,1 M], добавлен 19.04.2012
Сущность стадий транскрипции, процессинга и трансляции. Взаимодействие организмов в экосистемах. Биологическое значение в жизни организмов биоритмов и биологических часов. Анализ эволюции нервной системы животных от низших до высших многоклеточных.
контрольная работа [260,8 K], добавлен 21.12.2008
Свойство всех живых организмов со временем восстанавливать поврежденные ткани и целые потерянные органы. Физиологическая и репаративная регенерация, процессы эпиморфоза и морфаллаксиса. Происхождение полярности у организмов, сканирование их биосистем.
реферат [26,1 K], добавлен 08.06.2010
Воспроизведение себе подобных и обеспечение непрерывности и приемлемости жизни. Виды размножения и развития организмов, наиболее распространённая форма размножения и её значение. Строение яйцеклеток птиц, людей и животных. Растительный мир природы.
презентация [13,4 M], добавлен 26.03.2012
Адаптация растений к поддержанию водного баланса. Тип ветвления различных корневых систем. Экологические группы растений по отношению к воде: (гидато-, гидро-, гигро-, мезо-, ксеро-, склерофиты и суккуленты). Регуляция водного обмена у наземных животных.
реферат [22,4 K], добавлен 26.12.2013
Экологические зоны Мирового океана. Свойства водной среды (звук, электричество и магнетизм; солевой, световой, температурный режим) и ее роль в жизни гидробионтов. Адаптация растительных и животных организмов среде обитания. Фильтрация как тип питания.
курсовая работа [1,2 M], добавлен 16.12.2012
Наука о выведении новых форм живых организмов и задачи селекции по улучшению качества продукции, сортов и пород. Генетическое разнообразие растений, животных и их географическое распространение, гетерозис и инбридинг, их значение в природе и отборе.
презентация [3,0 M], добавлен 17.09.2012
Значение растворов в природе и жизни человека. Понятие о дисперсных, коллоидных и истинных растворах. Раствор и его компоненты: растворитель, растворенное вещество.
Главная > Урок
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Урок №3 Тема: Значение растворов в природе и жизни человека. Понятие о дисперсных, коллоидных и истинных растворах. Раствор и его компоненты: растворитель, растворенное вещество. Растворимость , ее зависимость от разных условий. Насыщенные и ненасыщенные растворы. Тепловые явления, сопровождающие растворение веществ. Физико-химическая суть процесса растворения.
Изучение нового материала (законспектируй)
 Сегодня мы с вами познакомимся с новыми понятиями : « дисперсная система» и « растворы»
Сегодня мы с вами познакомимся с новыми понятиями : « дисперсная система» и « растворы»
Система, в которой одно вещество в виде мелких частиц распределено в другом веществе, называется дисперсной системой.
Наибольшее значение в практике имеют дисперсные системы, в которых средой является вода. Дисперсные системы разделяются по размерам размещенных частиц
Агрегатное состояние распределенного вещества и среды, а также размеры частиц определяют свойства этих систем.

 Дисперсные системы
Дисперсные системы



Тонкодисперсные системы грубодисперсные системы
Молекулярные или коллоидные взвеси-размер частиц больше
 Истинные растворы растворы- 100 мкм
Истинные растворы растворы- 100 мкм

 Размер частиц не размер частиц
Размер частиц не размер частиц
превышает 1 мкм от 1 до100 мкм суспензии эмульсии


 (раствор яичного ( Ж+Т) пена (Ж +Ж)
(раствор яичного ( Ж+Т) пена (Ж +Ж)
твердые газ белка в воде) (глина+ (Ж+Г) (растительное
(сплав жидкие (воздух) вода) масло в воде)
 Растворы – это однородные системы сменного состава, содержащая два или несколько компонентов.
Растворы – это однородные системы сменного состава, содержащая два или несколько компонентов.
Компоненты растворов: растворитель и растворимое вещество.
Растворитель- количественно преобладает и находится в том агрегатном состоянии, что и раствор, который образуется.
Природа растворителя: подобное растворяется в подобном. Вода имеет полярные молекулы, поэтому в ней растворяются вещества с полярными связями
Растворяемое вещество может находиться в любом агрегатном состоянии. Так, в воде можно растворить сахар, а можно и спирт или углекислый газ
 Растворимость – это свойство вещества растворяться в воде или в другом веществе.
Растворимость – это свойство вещества растворяться в воде или в другом веществе.
Этот процесс сопровождается диффузией, т.е. перемещением молекул из более концентрированного раствора в области с меньшей концентрацией, т.е. вещества при растворении равномерно распределяется по всей массе растворителя, наступает химическое равновесие.
Растворимость определяется массой вещества, способного раствориться в 1000 г растворителя при данной температуре.
Растворимость веществ разная. Но совсем нерастворимых веществ в природе не существует. Например, даже атомы Аргентума в ничтожно малом количестве перейдут в раствор с серебряного предмета, погруженного в воду. Как известно, вода, которая была в контакте с серебром, убивает микробы
По растворимости в воде все вещества делятся на три группы.
1.Хорошо растворимые (более 10г в 1000 г воды)
2. Малорастворимые ( от10 до 0,01 г в 1000 г воды)
3. Практически не растворимые.( менее 0,01 г в 1000 г воды)
Говоря о растворимости надо указать температуру, т.к. растворимость многих веществ (твердых особенно) с увеличением температуры возрастает, что изображается графически.
Давление влияет на растворимость твердого вещества незначительно, т.к. при растворении не происходит заметного изменения объема.
При растворении газов в воде выделяется теплота, поэтому в соответствии с принципом Ле Шателье, растворимость газов возрастает со снижением температуры и повышением давления
 Типы растворов по содержанию растворенного вещества
Типы растворов по содержанию растворенного вещества
Раствор, в котором данное вещество при данной температуре уже больше не растворяется, называется насыщенным.
Раствор, в котором еще может раствориться добавочное количество данного вещества , называется ненасыщенным.
Ненасыщенные растворы бывают разбавленные и концентрированные
Разбавленные растворы- в определенном объеме раствора содержится мало растворенного вещества
Концентрированные растворы имеют относительно высокое содержание растворенного вещества
Это условные понятия. Например: 98% H 2 SO 4 и 38% HCL – концентрированные растворы
 Тепловые явления, сопровождающие растворение веществ
Тепловые явления, сопровождающие растворение веществ
При растворении веществ происходит два процесса.
разрушение структуры растворимого вещества
взаимодействие растворителя с частичками растворенного вещества.
Оба эти процесса связаны с изменением энергии системы вещество-растворитель.
Вывод: если сумма энергии гидратации всех ионов больше энергии, необходимой для разрыва связей между ионами, то растворение сопровождается выделением теплоты. . Если наоборот, то растворение сопровождается поглощением теплоты.
 Физико- химическая суть процесса растворения
Физико- химическая суть процесса растворения
Физическая теория: растворение – это процесс диффузии, а растворы – это однородные системы.
Химическая теория: растворение- это процесс химической взаимодействия растворенного вещества с водой- процесс гидратации.
Современная теория: Растворение- это физико- химический процесс, при котором происходит взаимодействие между частицами растворителя и растворяемого вещества, а раствор- это однородная система переменного состава, содержащая растворяемое вещество, растворитель и продукты их взаимодействия.
С какими новыми понятиями вы сегодня познакомились?
Дайте определение понятию « растворы», « дисперсные системы»
Сформулируйте современную теорию процесса растворения.
На какие группы делятся по растворимости в воде растворы?
Назовите факторы, от которых зависит растворимость веществ
Домашнее задание : изучить §4,5,6 и ответить на вопросы. Выучить основные понятия.
Урок № 4 (9 класс)
Тема: Вода как растворитель. Строение молекулы воды, понятие водородной связи. Понятие о кристалогидратах.
Изучение нового материала.
 Вода как полярный растворитель.( в конспект)
Вода как полярный растворитель.( в конспект)
Н 2 О- ковалентная полярная связь;
Н · + · О · + · Н →Н : О : Н →Н +d →О – 2 d ← Н +d
Атомы гидрогена размещены под углом 104,5 0 , что является причиной несимметричности структуры и полярности молекулы воды. Мы привыкли состав воды обозначать формулой Н 2 О, но правильно было бы состав воды записывать формулой (Н 2 О) х , где х= 2.3,4 и т.д., поскольку отдельные молекулы воды соединены водородными связям , которые схематично обозначаются точками





 Н Н +d …… О -d ……Н +d Н……
Н Н +d …… О -d ……Н +d Н……
Водородная связь возникает между водородом и электроотрицательным элементом.
Водородная связь значительно слабее , чем ионная или ковалентная, но более сильная, чем межмолекулярное взаимодействие. Образование водородных связей объясняется увеличение объема воды при снижении температуры. Этим также объясняется тот факт, что лед легче , чем вода и не тонет в ней.
Благодаря водородной связи вещество находится в жидком состоянии. Наличие водородной связи объясняет повышенная температура кипения, т.к. в этом случае необходимо затрачивать дополнительную энергию на разрушение водородных связей.
 Понятие о кристаллогидратах
Понятие о кристаллогидратах
При взаимодействии растворенного вещества с растворителем, образуются гидраты , если растворитель вода. Если другой растворитель, то образуются сольваты . Гидраты образуются за счет донорно-акцепторного ион-дипольного взаимодействия, за счет водородных связей. Гидраты – неустойчивые соединения и легко разрушаются при выпаривании воды из раствора. Тем не менее отдельные гидраты могут задерживать воду даже в кристаллическом состоянии. Такие вещества называются кристаллогидратами
Вещества, содержащие молекулы воды, называют кристаллогидратами . Вода кристаллизационной.
CuSO 4 * 5H 2 O – медный купорос; FeSO 4 * 7H 2 O-железный купорос
CaSO 4 * 2H 2 O – гипс Na 2 CO 3 * 10H 2 O- сода
При прокаливании или растворении кристаллогидраты разрушаются, выделяя столько же молекул воды, сколько входит в их состав.

CuSO 4 * 5H 2 O t CuSO 4 + 5H 2 O
 Рассказать методику выращивания кристалла.
Рассказать методику выращивания кристалла.
Проверка усвоения нового материала
Выполнение тестовых заданий ( в практике-письменно)
1) Выберите тип системы, в которой частицы растворенного вещества задерживаются бумажным фильтром:
А) раствор электролита; б) суспензия; в) коллоидный раствор; г) раствор газа
2) Укажите формулу гипса, который является кристаллогидратом:
А) CaSO 4 ×2H 2 O ; б )Ca(HSO 4 ) 2 ; в )Ca(OH) 2 ; г ) Ca 2 (OH) 2 SO 4
3) Раствор, в котором данное вещество при определенной температуре больше не растворяется , называется:
А) ненасыщенным ; б) насыщенным ; в ) концентрированным; г) разбавленным
4) Выберите характеристику , по которой растворы отличаются от механических смесей:
А) переменный состав ; б)тепловой эффект при образовании; в) агрегатное состояние
г) возможность выделения компонентов физическими методами
5) Выберите тип химической связи в соединениях, которые имеют высокую растворимость в воде:
А) ионная и и ковалентная полярная; б) ковалентная неполярная и полярная;
В) металлическая ; г)ионная и ковалентная неполярная
6) Растворимость каких веществ увеличивается при понижении температуры и повышении давления?
А) натрий хлорид; б) карбон(I˅) оксида; в) сахара; г)угарного газа
7) Отметьте продукты медленного прокаливания медного купороса:
А) вода ; б) сульфур (I˅) оксида; в) купрум (II) оксид; г)купрум (II) сульфат
 Как можно ненасыщенный раствор соли перевести в насыщенный:
Как можно ненасыщенный раствор соли перевести в насыщенный:
А ) добавить соли; б) добавить воды; в) нагреть раствор; г) выпарить часть воды
9) Почему лекарственные препараты применяют в виде растворов?
А) растворимые вещества полезнее; б) растворимые вещества быстрее усваиваются;
В)большинство лекарств растворимые ; г) в растворах лекарство легче дозировать.
10) Установите соответствие между термином и его значением:
А) гомогенная система, состоящая из 1) растворенное вещество;
Б) компонент, которого в системе 2) раствор;
В) компонент, которого в системе 3) растворитель;
Г) взвесь, в которой частицы одной 4) суспензия;
жидкости распределены в
другой жидкости 5) эмульсия
! Задания №1-5 имеют один верный ответ, задания № 6-9 – несколько верных ответов
Домашнее задание: изучить§6( стр.37), 7,8 и ответить на вопросы. Выучить основные понятия.
Осуществить превращение: Са→СaO→CaCO 3 →Ca(HCO 3 ) 2 →CO 2 →H 2 CO 3

Ca(OH) 2 →Fe(OH) 2 →FeOHCL→FeCL 2
Решить задачу: 1) Определить массу сульфатной кислоты необходимой для нейтрализации 20 г натрий гидроксида. 2) Определить металл массой 32.5 г, который растворили в растворе ортофосфорной кислоты, если в результате реакции образуется соль со степенью окисления металла +2 и выделяется газ объемом 11,2 л (н.у.)
Роль растворов в жизни человека.
Материал из ЗапоВики
Содержание
Общие сведения о растворах
Способность вещества растворяться в определенном растворителе, например в воде, называется растворимостью вещества в этом растворителе. Если одно вещество сильно измельчить и равномерно распределить в другом веществе, то образуется дисперсная истема.Диспернсные системы окружают нас повсеместно(воздух,кровь,лимфа).Это объясняется тем, что измельчённое вещество может находиться в трёх агрегатных остояниях.Но дисперсные системы бывают разных фаз.
Дисперсная среда в дисперсной фазе:
Газообразное в газообразном-Воздух
Газообразное в жидком – Туман.
Газообразное в твердом – Смог,пыль,дым.
Жидкое в газообразном – Пена.
Жидкое в жидком – Майонез,лимфа.
Жидкое в твердом – Кисель,студень,клей.
Твердое в газообразном – Пемза.
Твердое в жидком – Мазь,шампунь.
Твердое в твердом – Горные породы.
Наибольшее практическое значение имеют дисперсные системы, средой которых является вода. В зависимости размеров частиц, разделяют на три группы:
-истинные растворы(просто растворы)
-коллоидные растворы(содержат нерастворимое измельченное вещество)
-взвеси(эмульсии,суспензии)Примером эмульсии может быть молоко, где размельченным веществом являются капельки жира.
Коллоидный раствор
Кристаллы сульфата кобальта CoSO4 в растворе желтой кровяной соли K4
Эмульсия
 Молоко
Молоко
Суспензии и эмульсии при хранении быстро расслаиваются. В отличии от них коллоидные растворы более стойкие. Наиболее устойчивые среди дисперсных систем истинные растворы, в которых вецество размельчено до молекул и инов.
Вода-основной растворитель
Вода – растворитель большого количества химических веществ.Почти 3/4 поверхности Земли покрыто водой.Благодаря высокой способности растворять вещества, вода осуществляет на Земле грандиозную работу. В одном месте она разрушает горные породы, растворяет минералы либо вымывает из них растворимые вещества и переносит в растворённом виде на значительные расстояния, а в другом-вода испаряется, и растворённые в ней вещества осаждаются. Так со временем образуются новые миниралы и горные породы. Вода определяет климат и погоду в различных регионах земного шара. Пресной водф на Земле мало. Воду надо беречь, охранять природные водоёмы от загрязнения.
Роль растворов в жизни человека
Значение коллоидных растворов
Коллоидные растворы широко распространены в природе. Кровь, лимфа, внутриклеточные жидкости в организме являются коллоидными растворами белков и других веществ. Коллоидными растворами являются клеи и краски. Иногда в коллоидных растворах происходит слипание частиц (коагуляция), при этом образуются гели – студенистые вещества. Примером геля могут служить фотографическая эмульсия, применяемая для изготовления фотопленок и фотобумаг, а также такие продукты, как студень, мармелад. Всевозможные коллоидные системы. преимущественно аэрозоли, нашли применение в промышленности. В таких отраслях, как мыловаренная, маргариновая, фармацевтическая, парфюмерная, производство пластмасс, искуственного волокна, каучука и многих других, коллоиды изготовляют специально, поскольку это сырьё, например для резиновойЮ бумажной, кондитерской, текстильной промышленности. В технике образование аэрозолей процесс нежелательтный, поскольку загрязняется атмосфера. Над промышленными центрами возникают сложные аэрозоли, когда огромные массы дыма смешиваются с атмосферным туманом и пылью. При этом образуется смог, борьба с которым-актуальная экологическая проблема.
Значение истинных растворов
Растовры сопровождают нас всюду, и не только водные. Воздух-это взаимное растворение газов; чугун и сталь-твердые ратсворы железа и углерода. Но наиболее распространенными являются водные растворы. Усвоение пищи связанно с растворением питательных веществ. И растения усваивают необходимые для их роста и развития вещества только в виде растворов. Сок растений-это так же раствор. Обычная питьевая вода представляет собой раствор и твёрдых солей, и газов. Растворы играют большую роль во многих отраслях промышленности: в текстильной промышленности применяют растворы солей, кислот, красителей, металлообрабатывающей-растворы кислот (для удаления с поверхности металлов оалины и ражавчины), а в фармацавтической-растворами являются многие лекарства. Использование неводных растворов связано с полимерами, красителями, лаками и др. Вся промышленность синтетических волокон и пластмасс использует растворы. Химические, биологические и физические исследования часто приводят с применением растворов.
Что такое растворитель и растворенное вещество. Значение растворов в природе и жизни человека. Растворы и
Изучение параграфа поможет вам:
· приводить примеры водных растворов;
· различать растворитель и растворенное вещество.
Важным свойством воды является способность смешиваться с различными твердыми, жидкими и газообразными веществами. Если в результате смешения образуется однородная смесь, явление называют растворением.

Рис. 100. Схематическое изображение компонентного состава раствора
Вещество, растворяется, получила название растворенное вещество. Вещество, и которой растворяют — растворитель, а образованная смесь — раствор (рис. 100). Подслащенная сахаром вода является примером раствора, в котором сахар — растворенное вещество, вода — растворитель.
Раствор — однородная смесь, образованная несколькими веществами. Вещества, из которых образован раствор, являются его компонентами, среди которых различают растворитель и растворенное вещество.
Среди взятых для изготовления раствора веществ растворителем выступает компонент, что имеет одинаковое агрегатное состояние с раствором. Остальные составляющие раствора — где растворенные вещества. Если растворитель и растворенное вещество имеют одинаковое агрегатное состояние, то растворителем, как правило, называют компонент, масса которого больше.
Растворителем принято называть компонент раствора, содержание которого больше, и который имеет с раствором одинаковое агрегатное состояние.
Проверьте, так ли это правило в отношении растворения сахара в воде.
Растворителем может быть не только вода. Например, спирт используют в качестве растворителя при изготовлении различных медицинских препаратов (настойка йода, календулы и тому подобное). На свойствах ацетона растворять различные органические вещества основывается его использование в средствах для очистки поверхностей от лаков, красок и других покрытий.
Имея дело с растворами в повседневной жизни, вы часто меняете содержимое их компонентов. Так, чтобы не обжечься горячим чаем, можно долить в стакан холодной кипяченой воды. Если этот напиток недостаточно сладкий, то добавить сахара. Чтобы уменьшить содержание газов, растворенных в минеральной воде, оставляют бутылку открытой. Таким образом, состав растворов, как и любых смесей, можно произвольно менять, но в определенных пределах.
Растворы, в отличие от химических соединений, имеют произвольный состав.
Наличие растворенных веществ в растворе надует ему свойств, отличных от свойств растворителя. Все вы знаете, что чистая вода замерзает при температуре 0 °С, тогда как раствор поваренной соли имеет более низкую температуру замерзания. Она ниже, если большее содержание растворенной соли в нем. Поэтому тротуары посыпают кухонной солью во время гололеда.
Довольно часто цвет растворенного вещества передается раствора. Вот такие цвета у растворов: калий перманганата (1), медного купороса — (2), хром(III) сульфата — (3), феррум(III) хлорида — (4), калия дихромату — (5), никель(II) сульфата — (б), феррум (III) роданіду — (7) (рис. 101).
Растворы широко распространены в природе (рис. 102). Это воздух и молоко, облака и нефть, дождевая и морская вода, цитоплазма клеток и кровь человека и многие другие. В быту люди также часто имеют дело с растворами: уксусом — водным раствором уксусной (етанової) кислоты, минеральной водой — водным раствором газов (в основном углекислого) и неорганических веществ; сладким чаем, фруктовыми соками и тому подобное.
ОТ ЧЕГО ЗАВИСИТ СОДЕРЖАНИЕ РАСТВОРЕННОГО ВЕЩЕСТВА В РАСТВОРЕ? Количество частиц растворенного вещества, способных перейти в раствор, не безгранична. В этом несложно убедиться на таком опыте. В стакан нальем 100 мл воды комнатной температуры и насиплемо мерную ложку поваренной соли. После перемешивания соль быстро растворяется. Визуально мы ее присутствия в растворе не замечаем. Продолжим досыпать новые порции соли. Наконец после очередного высыпания и перемешивания она будет оставаться на дне стакана нерозчиненою (рис. 103). Это наступит тогда, когда будет достигнут предел растворимости соли в 100 г воды при комнатной температуре. Экспериментально установлено, что растворимость поваренной соли в воде комнатной температуры равен: около 35,9 г.

Рис. 101. Примеры растворов, имеющих окраску

Рис. 102. Растворы в природе и повседневной жизни человека

Рис. 103. Превращение ненасыщенного раствора поваренной соли в насыщенный

Рис. 104. Изображение способности различных веществ растворяться в воде: а — растворимые, малорастворимые, в — нерастворимые
Из параграфа 7 вы узнали, что по способности растворяться в воде при температуре 20-25 °C вещества условно делят на растворимые, малорастворимые и нерастворимые. Схематично смесь таких веществ с водой можно изобразить так, как на рисунке 104.
Следует отметить, что абсолютно нерастворимых веществ не существует. При пребывании в стакане с водой серебряной ложки мы не наблюдаем ее растворения, однако химический анализ воды из такого стакана выявляет наличие в ней частиц Аргентуму. Недаром для обеззараживания ран воины древнего Рима промывали их водой из серебряных сосудов, называя ее «серебряной водой». В украинских церквях использования воды из серебряных чаш во время обрядов посвящения является давней традицией.
Растворимость веществ зависит и от растворителя, и от вещества, которое растворяют. Так, в воде растворимость сахара высокая, тогда как в масле — очень низкая. Вещество может хорошо растворяться в одном растворителе и значительно хуже или вообще не растворяться в другом. Например, жиры не растворяются в воде, зато хорошо растворяются в бензине. Этим вы можете воспользоваться для удаления жирных пятен.
Из своевременного опыта вы знаете, что в теплой воде сахар растворяется лучше, чем в холодной. А вот газы при одинаковом давлении, но разной температуре растворяются в теплой воде меньше, чем в холодной. Поэтому газированную воду можно лишить газов нагреванием или кипячением. Растворимость газов зависит также от давления: чем давление выше, тем лучше происходит растворение. Это свойство используют при изготовлении газированных напитков, когда в напиток под давлением закачивают углекислый газ.
Растворимость большинства твердых веществ увеличивается с повышением температуры; растворимость газов увеличивается с понижением температуры и повышением давления. Мерой растворимости является максимальная масса растворенного вещества в 100 г растворителя при конкретных условиях.
Мы привыкли иметь дело с жидкими растворами. Однако среди растворов имеются и твердые, и газуваті. Главное, чтобы в любом агрегатном состоянии это были однородные смеси. Твердыми растворами являются стекло и различные сплавы, газуватим — воздух. И действительно, разве можно разглядеть в нем молекулы азота, кислорода, углекислого газа, воды?
ИССЛЕДУЕМ НА УРОКЕ И ДОМА
Вспомните, в чем заключается разделение смесей выпариванием.
В классе приготовьте раствор из воды объемам 50 мл и поваренной соли массой 15 г, налейте его в чашку для выпаривания. Поставьте чашку на кольцо штатива. Стеклянную воронку закрепите на лабораторном штативе (расширенной частью книзу над чашкой). Нагревайте над пламенем спиртовки чашку с раствором, пока вода полностью не испарится. Появление на стенках воронки капелек засвидетельствует, что растворитель испаряется.
Обратите внимание на вещество, которая осталась на дне чашки, ее цвет, агрегатное состояние. Наличие белого твердого вещества в чашке после выпаривания доказывает. что твердая растворенное вещество не испарилось.
На этом свойстве раствора поваренной соли базируется промышленное ее извлечения из рапы соленых озер.
Дома с помощью несложного опыта вы можете получить ответ на вопрос о том, что имеет большую плотность: вода или раствор поваренной соли.
Для его выполнения вам понадобятся 2 стеклянные банки объемом 0,5 л. вода комнатной температуры, поваренная соль, столовая ложка муки, 2 куриных яйца.
Заполните обе сосуда наполовину водой комнатной температуры. В одну добавьте 2 полные столовые ложки поваренной соли (это около 60 г), размешивайте, пока соль растворится. Поместите в каждую из них по куриному яйцу. Обратите внимание на то, что в одном сосуде яйцо опустилось на дно, а в другой держится в толще воды. В какой именно? На основе полученных результатов сформулируйте вывод о том, что имеет большую плотность: вода или раствор соли в воде.
Другой опыт — проведите с сахаром и водой. Один кусочек сахара положите в чашку с горячей водой, другую — в чашку с холодной. Наблюдайте, в которой сахар быстрее растворяется без помешивания? Объясните, почему.
1. Дайте определение раствора. Приведите примеры растворов в природе.
2. Из каких компонентов состоит раствор? Приведите примеры.
3. В какой воде содержание растворенных веществ меньше: ключевой, речной, колодезной? Почему вы так считаете?
4. Чем раствор отличается от неоднородной смеси, а чем — от сложного вещества?
5. Приведите примеры того, что одно и то же вещество имеет различную растворимость в зависимости от растворителя.
6. Напишите названия всех растворенных веществ, упомянутых в тексте параграфа.
7. Составьте перечень растворителей, о которых вы узнали из текста параграфа. Дополните его собственными примерами.
8. Заполните таблицу необходимыми сведениями.
Chemistry_1 / Растворы
Общая характеристика растворов.
Способы выражения концентрации растворов.
Термодинамика и механизм процесса растворения.
Вода как растворитель. Значение растворов в жизнедеятельности организмов
1. Общая характеристика растворов.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
2. Способы выражения концентрации растворов.
Относительное содержание компонентов в растворе определяется его концентрацией.
М 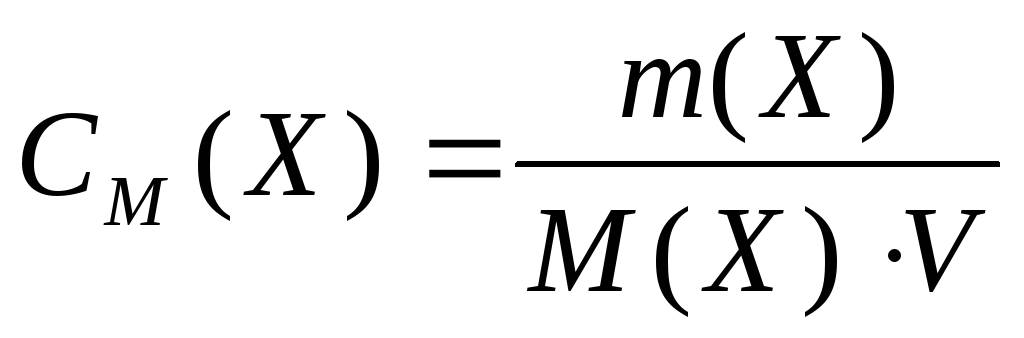 олярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
олярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
Э 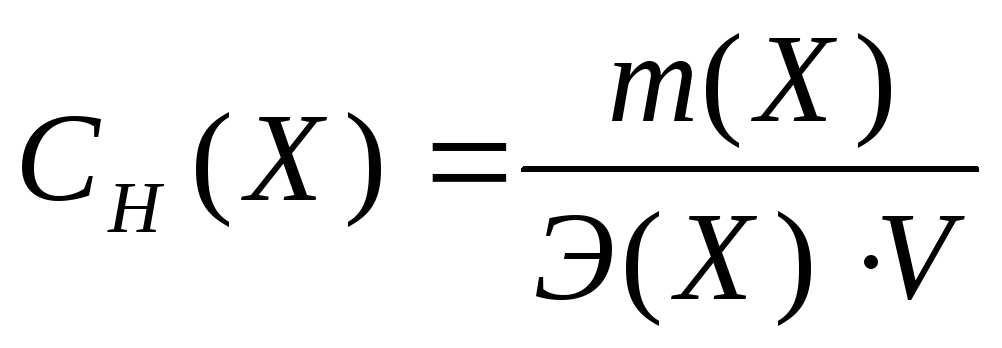 квивалентная концентрация – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
квивалентная концентрация – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л):
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
М 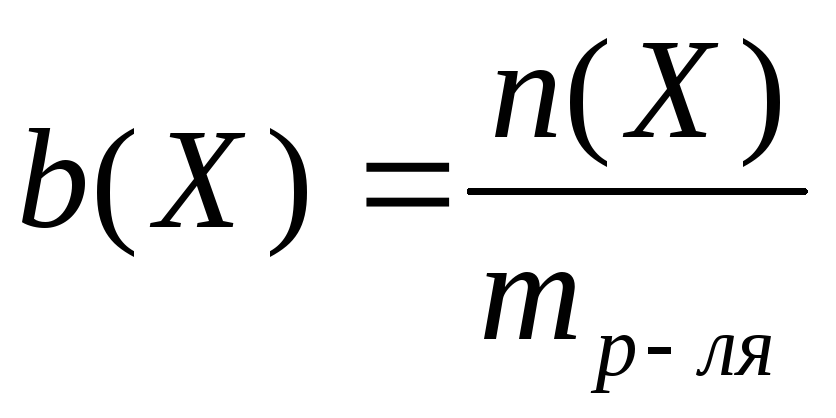 ассовая доля равна отношению массы растворенного вещества к массе раствора:
ассовая доля равна отношению массы растворенного вещества к массе раствора:
М 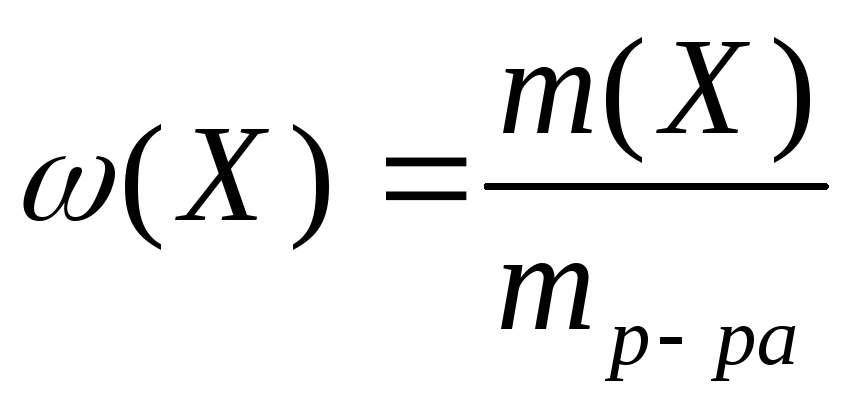 олярная доля равна отношению количества растворенного вещества в общему количеству веществ в растворе:
олярная доля равна отношению количества растворенного вещества в общему количеству веществ в растворе:
К 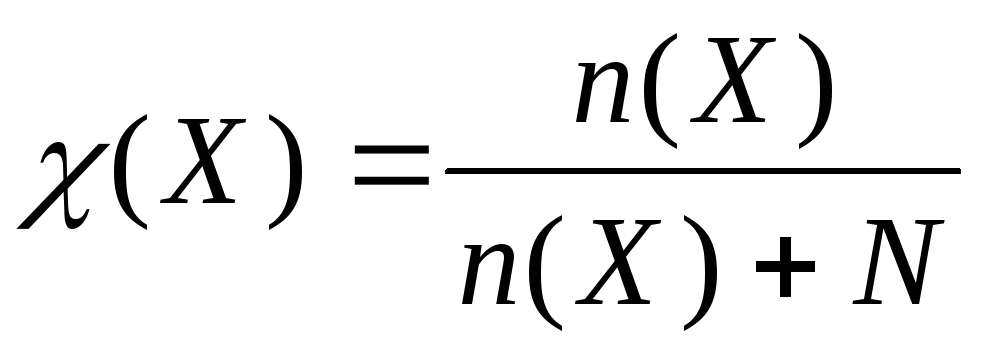 ак правило, вещество обладает определенной растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе.
ак правило, вещество обладает определенной растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе.
3. Термодинамика и механизм процесса растворения
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций Н и S:
разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): Н1>0, S1>0
химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): Н2 0, S3>0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: Sр-ния>0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемыми Н1 и Н2 и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермический Нр-ния>0, так как энергия, затрачиваемая на разрушение кристаллической решетки не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие тепмературы (|Н|







